1. RUBRIQUES INTRODUCTIVES
1.1.
Objet et Domaine d'application du présent Manuel
Le présent manuel a pour objet de décrire le système de management de la qualité mis en place
par le Centre de Ressources Biologiques de Lille.
Il s'applique à l'ensemble des processus et activités ayant un impact sur la gestion des
échantillons du Centre de Ressources Biologiques. C'est-à-dire qu'il s'attache
à des processus ou activités opérationnelles comme la réception, la
préparation, ou encore la conservation d'échantillons biologiques, mais
également à d'autres processus plus structuraux dénommés ci-après processus de
management et processus de soutien. On y classera la stratégie, la
communication, ou encore les achats, les ressources humaines.
1.2.
Présentation de l'entité, son organisation,
ses missions et ses activités
Le centre pilote de conservation et de gestion de collections d'échantillons a été crée en 2001 au sein du
Centre d'Investigation Clinique de Lille à la suite d'un Appel d'Offre INSERM-Ministère
de la Recherche. Son fonctionnement est soutenu par des apports financiers
hospitalo-universitaires.
Le Centre de Ressources Biologiques est ainsi implanté au cœur du Centre Hospitalier Régional
Universitaire de Lille dans les locaux de l'hôpital cardiologique.
Le Centre de Ressources Biologiques a pour vocation de gérer et conserver des ressources biologiques
humaines (sang, sérum, plasma, tissus, selles, LCR, biopsies, Muqueuses
intestinales, larmes, moelle osseuses, cellules purifiées, urines, condensas
air expiré, ...) et leurs dérivés (cellules, ADN, ARN,...) pour l'ensemble de
la communauté scientifique. La liste des collections d'échantillons biologiques
entrant dans le périmètre du système de management de la qualité est éditée
dans la Liste Gérée (LG) Collections dans le champ du Système de Management Qualité.
1.3.
Définitions
Centre de Ressources Biologiques (CRB):
Un CRB est un organisme qui réalise au moins les activités de réception (y compris les activités de
collecte et de création pour les microorganismes), de conservation et de mise à
disposition de ressources biologiques en particulier à des fins de recherche,
d'éducation et de valorisation industrielle.
Les ressources biologiques d'origine humaine peuvent être issues d'activités de diagnostic. En revanche
les collections à usage thérapeutique n'entrent pas dans ce cadre.
Cette définition est issue d'une norme nationale NF S 96-900 et le terme est retenu au niveau international dans
le cadre de l'OCDE (
http://www.oecd.org/dataoecd/7/11/38777441.pdf).
D'autres termes sont utilisés comme biobanque, biothèque, tumorothèque, etc.
COLLECTION :
Utilisé pour le terme collection d'échantillons biologiques humains : Réunion à des fins scientifiques, de prélèvements
biologiques effectués sur un groupe de personnes identifiées et sélectionnées
en fonction des caractéristiques cliniques ou biologiques d'un ou plusieurs
membres du groupe, ainsi que des dérivés de ces prélèvements (Art. 1243-3 CSP).
PRELEVEMENT BIOLOGIQUE:
Matériel biologique issu du sujet quelque soit le mode de recueil.
ÉCHANTILLON BIOLOGIQUE:
Matériel biologique sur lequel va (vont) être effectué(s) une ou plusieurs analyses de biologie médicale
RESSOURCES BIOLOGIQUES :
Terme générique désignant le matériel biologique et les données associées (annotations)
INITIATEUR :
Personne ou structure publique ou privée à l'origine du projet de collection d'échantillons biologiques humains.
DEPOSANT :
Personne ou structure publique ou privée à l'origine du dépôt des ressources biologiques.
UTILISATEUR :
personne ou structure publique ou privée autorisée à utiliser, dans le cadre
d'un projet de recherche, des ressources biologiques stockées au CRB.
2. SYSTEME DE MANAGEMENT DE LA QUALITE
2.1.
Les processus concernés
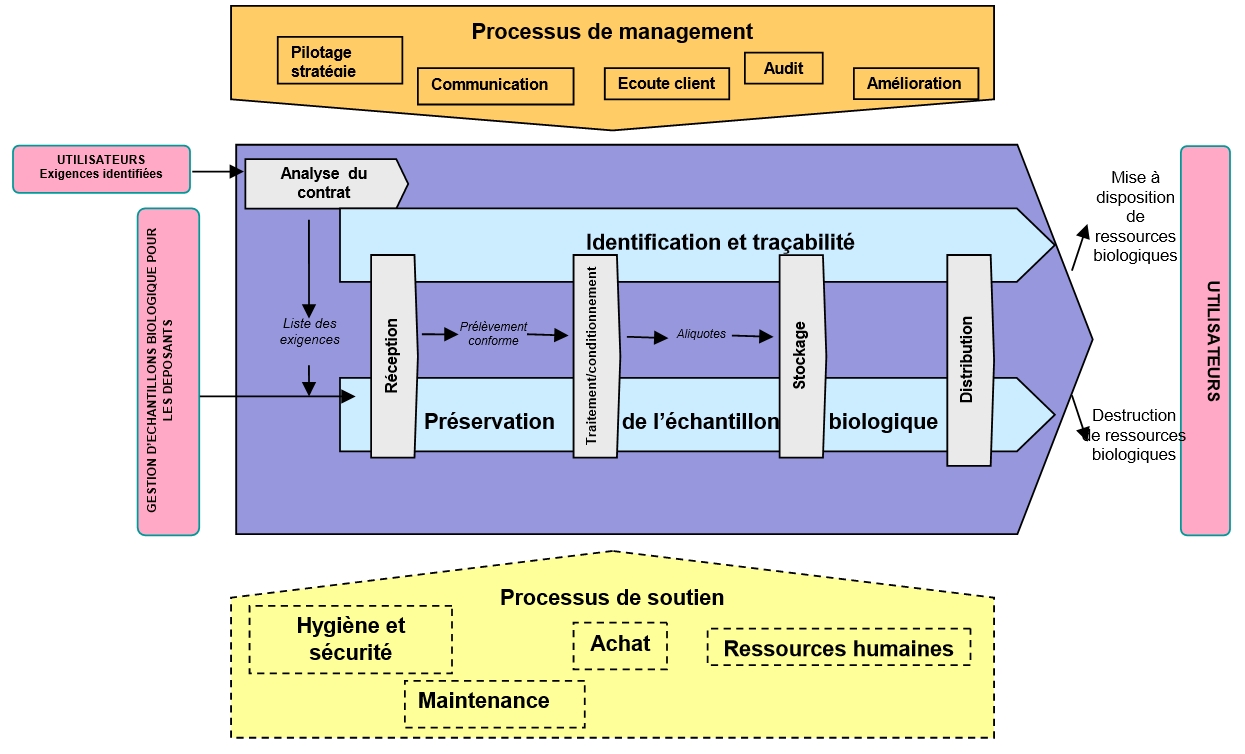
Les activités du Centre de Ressources Biologiques ont été définies en un ensemble de processus ayant une
influence directe sur la prestation du service. Elles ont été identifiées, et
peuvent être visualisées de manière générale dans la cartographie ci-après.
Les processus de soutien sont de processus dits externalisés.
Pour le processus « Transport », le CRB fait appel à des prestataires de service. Pour
ce qui est des processus de « Maintenance », « Hygiène et
sécurité », « Achats », « Ressources humaines »,
« Informatique », le CRB est utilisateur des systèmes mis en place par
les organismes de tutelles : le CHRU de Lille, l'Université de Lille II et
l'INSERM.
Il existe une Fiche d'identité - Processus pour chaque processus.
2.2.
Documentation
2.2.1.
Maîtrise des documents :
Toutes les activités techniques
ou administratives jouant un rôle dans la gestion des échantillons biologiques et
toutes les activités liées à la gestion du système de management de la qualité
sont formalisées dans un ensemble de documents répartis sur 3 niveaux :
- le 1er niveau est celui du manuel qualité
- le 2éme niveau comprend les procédures (PG, PR, FI)
- le 3éme niveau, les définitions de fonctions, modes opératoires, documents types, listes gérées et les fiches d'enregistrement.
La gestion du document est
matérialisée par des bandeaux de gestion où sont rassemblés tous les
identifiants (entité responsable, titre, type de document, version, date, références,
responsabilité, liste de diffusion, signatures). Des masques ont été créés et
sont accessibles par l'informatique.
La maitrise des documents est
détaillée dans une procédure générale PG/CRB/Procédure des procédures et
l'ensemble des documents est visualisable par la liste gérée des documents
qualité en vigueur.
2.2.2.
Gestion du Manuel Qualité :
Le Manuel Qualité est
géré par le directeur du Centre de Ressources Biologiques en collaboration avec
le Responsable du Système Qualité.
Les révisions ont lieu de façon
systématique à l'occasion de chaque revue de direction, et à chaque date
anniversaire de la création du Manuel Qualité.
Il est remis à jour, le cas échéant, et une nouvelle version est mise en vigueur.
Il est diffusé auprès des pilotes de processus de l'entité, ceux-ci ont en charge de le porter à la connaissance de
leurs collaborateurs afin de recueillir leurs commentaires et demandes
d'explications éventuelles.
Il fait partie des documents d'assurance qualité propres à l'entité et est consultable par
l'ensemble du personnel.
Le Manuel Qualité peut être envoyé, en copie intégrale ou partielle, comme document non géré aux
clients qui en font la demande ou comme pièce attachée aux appels d'offres.
2.2.3.
Maîtrise des enregistrements :
Les enregistrements, preuves ou
résultats d'une activité formalisée dans une procédure ou un mode opératoire
sont gérés conformément aux dispositions décrites dans des fiches d'enregistrement.
En l'absence de fiche, les
principes applicables sont directement intégrés au document le plus approprié
(procédure, mode opératoire).
Certains enregistrements ont une
importance particulière pour le fonctionnement du système de management de la
qualité, ce sont les enregistrements qualité.
Il existe une liste gérée des
enregistrements Les enregistrements qualité sont signalés sur la liste par
une marque distinctive.
2.2.4.
Documents normatifs et règlementaires :
Les documents normatifs et
réglementaires d'origine externe sont mis à disposition au niveau du réseau
informatique du CRB soit sur le X/CAR/CIC/CRB/Réglementaire.
La liste gérée LG/CRB/003/Liste
des lois et réglementation et conformité, liste des documents externes
applicables, reprend ces documents.
3. RESPONSABILITE DE LA DIRECTION
3.1.
Engagement de la Direction
La direction s'engage à ce que la
politique d'amélioration continue de la qualité et de la sécurité soit mise en
œuvre de façon permanente et vérifiable à tout moment afin de s'assurer de la
satisfaction des clients.
L'adhésion à la démarche de
l'ensemble du personnel du Centre de Ressources Biologiques est obligatoire.
3.2.
Composition de la Direction
La fonction de Directeur du
Centre de Ressources Biologiques est confiée à M. le Pr. LIBERSA. Il est
assisté dans ses missions par M. le Dr DEPLANQUE, Directeur adjoint.
M. GELE est nommé en tant
que Responsable Opérationnel du Centre de Ressources Biologiques.
3.3.
Politique Qualité :
Le CRB s'engage à mettre en avant
les processus d' « Identification et de traçabilité » et de
« Préservation du produit » ayant un impact évident sur la qualité
des échantillons et collections biologiques qui lui sont confiés.
Le CRB s'appuie donc sur :
− La maîtrise des savoir-faire de professionnels impliqués,
− des savoir-faire de professionnels impliqués,
− Le souci d'anticipation et d'adaptation continu de l'organisation,
− Un système d'assurance qualité éprouvé,
− La veille réglementaire et normative,
afin de pouvoir apporter à ses
clients (initiateurs, déposants, utilisateurs) l'assurance que les ressources
biologiques seront traitées avec le plus grand professionnalisme.
La mise en œuvre du système
qualité permettra, outre la communication de l'image de marque du CRB, une
meilleure visibilité des collections gérées et assurera à l'initiateur ou au
déposant plus de possibilités de valorisation, notamment par l'intégration de
projets de recherche de haut niveau français, européens, et internationaux.
3.4.
Planification de la qualité et objectifs qualité :
Des objectifs qualité et leur(s)
indicateur(s) associé(s) ont été définis afin de satisfaire aux exigences de
conformité aux référentiels normatifs, de satisfaction des attentes des
clients, de sécurité des pratiques, d'efficience de l'organisation :
Ainsi 7 objectifs qualité sont identifiés :
1 – L'accent sera mis sur la
préservation de l'intégrité des échantillons en se basant sur un objectif de : « 1/5000
échantillons gérés, éliminés pour cause de dérive de pratique ».
L'indicateur associé est le
« nombre de non conformité enregistrée, associée à un certificat de
destruction, ».
2 –L'objectif qualité relatif au
délai de réponse est le suivant : « 0 dysfonctionnement en terme de
délai de sollicitation(s) ».
L'indicateur associé est le « % du délai de réponse (% de temps dépassé sur la base des 24h) ».
3 – Dans le domaine relatif à
l'exhaustivité des enregistrements des données contenues dans le dossier de lot
d'échantillon et dans le progiciel de gestion Databiotec®, une analyse et une
évaluation sont systématiquement programmée
L'objectif est le suivant : « 95 % d'exhaustivité des enregistrements ».
Les intervenants sont tenus
d'enregistrer les données attendues, les informations impératives exigées par
les modes opératoires.
Les informations impératives du
dossier de lot sont marquées d'une * et font l'objet d'une vérification
physique dans les enceintes de stockage.
Le calcul de l'indicateur d'exhaustivité
est le suivant : « Nombre de données observées / nombre de données
attendues ».
L'objectif qualité relatif à
l'exactitude des enregistrements est le suivant : « 10 %
des enregistrements sont inexacts ».
L'Indicateur associé est
le « Nombre de données exactes et cohérentes/ nombre de données
attendues »
4 -L'objectif qualité proposé
concernant les preuves de la traçabilité est le suivant : « 0
réclamation portant sur la présentation des preuves de traçabilité exigées par
le contrat ».
L'Indicateur associé est
le « nombre de réclamations portant sur la traçabilité enregistrées
dans le trimestre »
5 – L'objectif qualité relatif
aux règles de stockage est le suivant : « Moins de 5
dysfonctionnements critiques relatifs à la température de conservation des
échantillons par mois et à la localisation lors du contrôle mensuel du
stockage ».
L'indicateur associé est le « Nombre d'anomalies de stockage constatées »
6 – L'objectif qualité proposé en
matière de maîtrise des compétences est le suivant : « Moins de
20% des fiches individuelles de compétences nécessitent une remise à jour
semestrielle (y compris pour les stagiaires, intérimaires et nouveaux
arrivants) ».
L'indicateur associé est le
« Nombre de fiches de compétences remises à jour / Nombre de fiches de
compétences total ».
7– L'objectif relatif au système
de sécurité est le suivant : « 90% des alertes sont gérées et
donnent lieu à une conclusion »
Chaque alarme fait l'objet d'une
fiche de gestion comprenant une instruction et une conclusion validée par le
responsable sécurité.
L'indicateur associé est
le « Nombre de fiches de gestion complétées et approuvées / Nombre de
fiches de gestion total».
Les indicateurs sont incrémentés
selon une périodicité propre à chaque indicateur et reportés sur les tableaux
de bord. Chaque indicateur fait l'objet d'une fiche d'instruction.
L'évolution des indicateurs est présentée et discutée en Revue de Direction.
3.5.
Communication en matière de qualité :
La communication interne en matière de qualité est organisée comme suit :
Chaque professionnel investi
d'une fonction d'autorité a la responsabilité de transmettre à ses
collaborateurs toutes les informations dont il dispose et qui peuvent leur être
utiles dans leurs activités quotidiennes :
− La politique qualité, ses évolutions
− Le système de management de la qualité, son état, son efficacité
− L'état d'avancement des travaux, les actions correctives, préventives
− Les dysfonctionnements internes et ceux rencontrés en clientèle
Cette responsabilité est rappelée dans les définitions de fonctions
En permanence, un tableau
d'affichage, accessible à tous, reprend l'état d'avancement des projets qualité
et les tableaux de bord remis à jour.
Tous les mois, une réunion des
pilotes de processus permet d'échanger sur les évènements marquants, dont ceux
relatifs à la qualité ou aux dysfonctionnements.
La communication externe en matière de qualité revient à la Direction :
La communication externe à
destination des clients et des partenaires ou des tutelles s'attache à
expliquer la politique qualité du Centre de Ressources Biologiques, l'existence
d'un système de management de la qualité, ses implications et ses résultats au
bénéfice des patients.
Les nouveaux clients sont
systématiquement informés de l'existence du système de management de la
qualité.
3.6.
Revue de Direction :
Les revues de système qualité sont programmées tous les six mois.
La Direction se réserve le droit d'en annuler une ou d'en ajouter une.
L'ordre du jour de la revue comporte des thèmes systématiques exposés par des rapporteurs désignés.
Chaque rapporteur fait état de la situation en comparant par rapport à la revue précédente lorsque
cela est possible.
Des thèmes occasionnels peuvent être inscrits à l'ordre du jour.
Les thèmes systématiques sont :
− Retour sur la revue précédente
− Etat d'avancement de la démarche qualité dans les secteurs :
Chaque pilote de processus fait le point sur ses actions (communication, assurance qualité
− Les indicateurs associés aux processus
− L'état du système documentaire
− Management des ressources :
o Ressources humaines (formation, nouveaux arrivants)
o Matériel et infrastructure
− Mesures, analyses et amélioration :
o Le programme d'audits (état de réalisation)
o Fiches écart
o Réclamations
o Maîtrise des non conformités, actions correctives et préventives
o Mesure de la satisfaction des clients
− Les changements récemment intervenus ou à prévoir et leur impact sur le système de management de la qualité
Chaque revue de direction donne lieu à un compte rendu comportant la conclusion et les directives du Directeur
du Centre de Ressources Biologiques. Le compte rendu est diffusé auprès des
pilotes de processus et est tenu à la disposition de tout membre du personnel le
demandant.
4. MANAGEMENT DES RESSOURCES
4.1.
Ressources humaines :
S'agissant d'une activité de service liée à des collections d'échantillons biologiques humains, les
compétences en terme de savoir faire doivent être optimales.
Chaque fonction repérée dans l'organigramme fonctionnel du Centre de Ressources Biologiques est décrite
dans un document d'assurance qualité de type Définition de fonction. DF/CRB/001 à DF/CRB/007
Les autorités et responsabilités en matière de qualité sont précisées, pour chaque fonction dans
les définitions de fonction.
Chaque nouvel arrivant a connaissance de sa (ses) définition(s) de fonctions dès son embauche.
4.1.1.
Affectation du personnel
Pour chaque membre du personnel, il existe une fiche de compétence.
A l'arrivée d'un nouvel arrivant, la liste des compétences requises pour le poste est mise en regard des
compétences acquises de la personne. Ainsi un programme de formations initiale
et continue, interne, est élaboré avec la désignation de tuteurs. A chaque
validation de l'acquisition d'une compétence, la fiche de compétence est mise à jour.
4.1.2.
Responsabilité et autorité en matière de qualité :
La Direction du CRB :
Elle coordonne le travail de
l'unité, garantit que la politique qualité est cohérente avec la stratégie de
l'unité et qu'elle est connue et comprise des parties prenantes.
Elle valide l'ensemble des projets en lien avec les objectifs, la construction du système de management de
la qualité, son fonctionnement et ses résultats et assure la disponibilité des
moyens adéquats.
Le Responsable Qualité :
Il conseille la direction sur la
politique qualité du Centre de Ressources Biologiques.
Il définit les objectifs qualité
et leurs indicateurs associés. Il planifie et anime les revues de direction.
Il gère la base documentaire normative ainsi que la base des enregistrements.
Il gère les écarts, actions correctives, préventives.
Il assure le bon fonctionnement du système qualité du Centre de Ressources Biologiques.
Il organise les processus du système qualité et vérifie leur efficacité.
Les Pilotes de Processus :
Chaque pilote de processus agit en tant que chef de projet pour tous les travaux de construction du système
qualité concernant son domaine d'expertise. Il est responsable du bon
déroulement des activités de son secteur, de leurs résultats et a la charge de
signaler tout écart dont il a connaissance.
Il s'assure de la connaissance et de la compréhension des exigences en matière de qualité, par ses collaborateurs.
La liste des domaines d'expertise est établie comme suit :
− Achats
− Gestion des stocks
− Ressources humaines
− Hygiène et sécurité
− Maintenance
− Gestion de bases de données
− Communication externe
− Système Qualité
− Achats
− Achats
− Achats
4.1.3.
Formation et qualification :
Pour chaque fonction, les compétences en termes de savoir, savoir-faire et savoir être sont définies. Chaque membre
du personnel dispose d'une fiche individuelle de compétences prenant en compte
sa formation initiale et intégrant les compétences acquises au fur et à mesure
de l'expérience ou des formations qualifiantes effectuées.
4 niveaux de compétences (savoir-faire) sont définis :
− ne sait pas faire
− sait faire avec un tuteur
− sait faire seul
− a un niveau d'expertise lui permettant de former un autre agent.
Le programme de formation, interne et externe, se développe et donne lieu à des enregistrements dans les
dossiers individuels.
Lors de l'évaluation annuelle, une revue complète des niveaux de compétences pour la réalisation des
tâches est effectuée par le Directeur ou l'expert, et les niveaux sont
enregistrés. Les besoins de formation complémentaires sont définis et sont
inclus soit dans une planification individuelle de formation, soit dans une
planification plus large pour un groupe de personnes.
Lors de la mise en place de nouvelles tâches ou nouvelles techniques, les précisions sont données lors des
réunions relatives aux collections et si nécessaire, font l'objet de formations
spécifiques enregistrées dans le dossier individuel.
4.1.4.
Sensibilisation :
Toutes les personnes impliquées opérationnellement dans le système qualité reçoivent une
sensibilisation au fonctionnement du système qualité.
Les séances de sensibilisation sont enregistrées. Une liste d'émargement des personnes
présentes est établie.
4.2.
Infrastructure et équipement :
4.2.1.
Infrastructure :
Les locaux de CRB sont mis à
disposition par le Centre d'Investigation Clinique de Lille.
du CRB a souhaité mettre l'accent sur la sécurité
physique des locaux. Elle a donc équipé le service en 2004 d'un système
anti-intrusion. En effet, afin d'assurer la protection des biens, des données
et des personnes, l'entrée dans le CRB s'effectue sous le contrôle d'un système
de gestion informatisé des portes et d'une vidéosurveillance. Ce système permet
de contrôler l'accès à ces locaux sachant que les autorisations et horaires
d'accès sont personnalisés.
Afin de répondre aux exigences élémentaires
d'hygiène, les locaux ont été conçus de manière à permettre un nettoyage et un
entretien efficace en vue de limiter les atteintes à la qualité des
échantillons manipulés.
Les locaux répondent également aux exigences élémentaires pour la santé des personnes et du personnel autorisé
à pénétrer sur le site, en s'appuyant sur un certain nombre de procédures
diffusées puisque en commun avec celles de l'établissement hospitalier universitaire
de Lille (exigences liées aux risques infectieux, liés aux risques chimiques,
liées aux risques découlant de l'utilisation de l'azote, sécurité incendie).
4.2.2.
Equipement :
Le matériel contribue de façon
très importante à la qualité des échantillons pris en charge par le CRB. Ceci
est valable essentiellement pour les étapes de préparation (traitement,
conditionnement) et de stockage des ressources biologiques.
La prise en charge du suivi des matériels présents au CRB fait l'objet d'un dispositif documenté.
En effet la direction a défini
les dispositions nécessaires pour assurer la maintenance des matériels, dans le
but de répondre aux recommandations des déposants et aux contraintes
réglementaires et légales. Différents documents ont été mis en place pour gérer
le suivi des matériels, à savoir une liste gérée « Maintenance et
étalonnage des matériels » (LG/CRB/002), un dossier par matériel
comprenant la notice d'utilisation, un contrat de maintenance, une fiche de
vie. Les maintenances sont gérées par le référent matériel via la programmation
de tâche Outlook.
Une attention plus particulière
est apportée aux matériels de conservation ; la température de
conservation des échantillons étant un paramètre essentiel à maîtriser afin de
garantir la stabilité des propriétés des échantillons stockés dans les
conditions définies par le donneur d'ordre.
Ont donc étés mis en place :
- une maintenance préventive en
complément d'une maintenance curative en cas de dysfonctionnement avéré du
matériel de conservation,
- un enregistrement continu des
températures des matériels de conservation en sus d'un relais à la centrale
d'alarme du CHRU, signalant ainsi au Responsable Sécurité du CRB, tout
dysfonctionnement.
Ce système permet de déclencher les actions correctrices et correctives nécessaires.
4.2.3.
Système d'information
Le CRB s'est équipé en 2004 d'un
système informatique de gestion des échantillons : le progiciel DATABIOTEC®
produit par la société ORIAM.
gestion et la traçabilité des échantillons des essais cliniques permettant de
gérer :
Le référencement (étude, sujets,centres, intervenants, prélèvements, échantillons, ...)
Le stockage (gestion des conteneurs et des emplacements de conservation),
La traçabilité des échantillons (entrée,sortie, problèmes rencontrés, ...),
L'édition de rapport,
L'étiquetage des échantillons (code barre, 2D, ...),
La recherche multicritères,
Le paramétrage de programme (adaptation aux spécificités d'un site),
Les audits de connexion
Le cryptage des données sensibles,...
La base de données issue de
DATABIOTEC® est soumise au système de déclaration à la
CNIL, conformément à la réglementation en vigueur.
Techniquement, le progiciel
DATABIOTEC®, fonctionne en mode client-serveur. Le serveur de données est une
base ORACLE et le client a une interface Access 2000.
Un dispositif de sécurité est mis
en place pour réglementer et sécuriser l'accès aux données de la base de DATABIOTEC®.
Les données sont consignées et exploitées à partir des 2 postes du CRB.
La visualisation et l'utilisation
des données n'est possible qu'à partir des postes du CRB où sont installés DATABIOTEC®,
l'accès de ces postes étant limité par un contrôle d'accès aux locaux et complété
par des protections logistiques.
Une sauvegarde systématique est
effectuée quotidiennement sur un secteur protégé du serveur sécurisé du CHRU de Lille.
Les données incrémentées dans DATABIOTEC®
sont protégées par 2 niveau d'entrées
Le 1er niveau est la
connexion au réseau du CHRU de Lille, le second niveau est l'entrée dans le prologiciel DATABIOTEC®.
Pour cela, une application d'accueil contrôle les accès aux systèmes d'informations du CHRU de Lille.
En aucun cas il existe une
interconnexion de DATABIOTEC® avec le réseau informatique du CHRU de Lille.
Seuls les 2 postes du CRB équipés du logiciel (sur disque dur) peuvent
visualiser les données de la base de données de DATABIOTEC®.
4.3.
Environnement de travail :
Des règles de flux (personnes,
produits, matériels, déchets) sont en place pour la zone de préparation pour
garantir la propreté du matériel et des locaux, et la bonne tenue des stocks.
5. MANAGEMENT DES PROCESSUS OPERATIONNELS
5.1.
Planification de la réalisation du produit
Le CRB de Lille a pour vocation de gérer et conserver des échantillons biologiques humains pour les déposants
et utilisateurs de collection.
A partir des 2 processus
opérationnels, « Identifications et traçabilité des échantillons » et
« Préservation du produit », une planification a été mise à plat. De
cette planification, les activités critiques sont mises en exergues et
permettent de constituer le système qualité.
5.2.
Les exigences clients
Les exigences du client, du
produit et les exigences légales sont actées dans un protocole de recherche
clinique;
Les exigences spécifiques du
client, mais également du CRB de Lille sont reprises dans un document
spécifique, la « charte client-CRB ». Chaque
charte est ainsi associée à une liste d'exigences qui comprend celles associées
à la logistique et à la communication. Cette liste est approuvée par le
directeur du CRB.
5.3.
Communication avec le client, information du client
Le CRB de Lille s'est engagé en termes
d'objectifs à répondre aux sollicitations des clients dans les délais convenus
lors de l'établissement de la charte. Cf. 3.3
5.4.
Achats et approvisionnements
Les produits consommables jouant
un rôle dans l'obtention de la qualité sont repris dans la
LG/CRB/consommables dits sensibles.
L'entité CRB étant sous la
tutelle du CHRU de Lille, de l'INSERM, les achats effectués sont soumis à la
réglementations des marchés publiques.(Appel d'offres, devis concurrentiels, ...).
Toutefois les achats ne sont lancés qu'après une évaluation interne des
besoins, et des exigences en relations avec la qualité des échantillons
biologiques.
Chaque réception de colis fait
l'objet d'un enregistrement et d'un contrôle avant acceptation.
Les enregistrements des
dysfonctionnements et maintenances des appareils participent au choix des
fournisseurs pour les achats à venir et permettent d'avoir une information sur leur
fiabilité dans le temps.
5.5.
Réalisation des prestations
5.5.1.
Identification et traçabilité
L'identification et la
traçabilité des échantillons constituent un processus transversal aux activités
de réception, de préparation, de stockage et de mise à disposition des
échantillons biologiques que prend en charge le CRB.
Son importance est telle qu'il
est mis en exergue en tant que processus opérationnel dans le système qualité.
5.5.2.
Propriété du client
Ce paragraphe est exclu du champ de la certification ISO 9001/2008
5.5.3.
Préservation du produit
La préservation des échantillons
biologiques constitue un processus transversal aux activités de réception, de
préparation, de stockage et de mise à disposition des échantillons biologiques
que prend en charge le CRB.
Son importance est telle qu'il
est mis en exergue en tant que processus opérationnel dans le système qualité.
5.6.
Maîtrise des dispositions de mesures et de surveillance
Tous les appareils utilisés pour
des mesures qualifiantes sur un produit ou pour la continuité d'un processus
font l'objet d'une vérification de conformité métrologique adaptée.
Une liste gérée et une "check
list" de contrôle présentent l'ensemble des dispositions en place.
Les données, les résultats et les décisions des vérifications sont enregistrés.
6. MESURES, ANALYSE et AMELIORATION
6.1.
Mesure de la satisfaction des clients
Le CRB de Lille mesure la
satisfaction des ses clients par l'analyse des réclamations clients.
6.2.
Audits internes
Les audits programmés se situent
dans le cadre d'un suivi systématique, donc de façon planifiée.
Le planning d'audit du CRB de
Lille prévoit que chaque point de la norme soit audité au moins une fois sur
une période de 2 ans.
L'audit doit couvrir les entités
concernées par le thème (entités opérationnelles/fonctionnelles) et l'ensemble
des activités, prendre en compte tous les critères, et être effectué à temps.
Il est possible que des audits non
planifiés soient déclenchés à la suite de circonstances particulières, par
exemple, à la suite de problèmes répétés, pour vérifier la mise en oeuvre
d'actions d'amélioration, par manque de connaissance dans la maîtrise
d'activités.
L'audit des processus du système
de management de la qualité est réalisé par un auditeur externe.
Les audits sont réalisés par des
auditeurs habilités indépendants de la situation à auditer. La liste des
auditeurs qualifiés est la liste gérée LG/CRB/Liste des auditeurs internes.
Une procédure décrit les modalités de conduite des audits.
L'état d'avancement du programme d'audit est examiné en revue de direction ainsi que les résultats obtenus.
Les comptes rendus d'audit sont des enregistrements qualité.
6.3.
Surveillance des processus
Les processus opérationnels et de
soutien tels que le processus ressources humaines, processus hygiène et sécurité,
processus de maintenance font l'objet de surveillance et de mesure. Les
résultats sont dans des tableaux de bord et sont analysés en Revue de
Direction.
Si toutefois les objectifs ne
sont pas atteints, des mesures correctives sont mise en place.
6.4.
Surveillance de la prestation
Au fur et à mesure de la prise en
charge du prélèvement/échantillon biologique au sein du CRB, ce dernier fait
l'objet de multiples enregistrements et contrôles de façon à garantir sa
conformité aux exigences réglementaires et du client. FE/CRB/001 – Dossier de
lot d'échantillons.
Chaque mise à disposition
d'échantillons biologiques, fait l'objet soit de termes spécifiques dans l'engagement
établi en amont de la collaboration déposant/CRB, soit d'une analyse de la
demande d'un utilisateur par le Comité Scientifique de la collection et le
Comité Scientifique et Directorial du CRB de Lille.
6.5.
Maîtrise des non conformités
La qualification d'un écart, en
NON CONFOMITE est le résultat d'un processus décisionnel décrit ci-après.
Détection d'un écart :
Les écarts sont détectés dans
n'importe quelle situation, par tout agent participant à une activité ou lors des
audits ou lors des contrôles.
Ils peuvent être :
− le fait de personnes extérieures au système qualité (le client, un partenaire, un
fournisseur) ou d'un évènement extérieur.
− en relation :
·
Soit avec des exigences internes formalisées (procédures, instructions écrites), soit avec
des exigences externes (normes, règlements)
·
Soit avec des exigences du client.
Note : Une réclamation peut être considérée comme un écart.
Qualification des écarts :
Le traitement d'un écart prend en compte la criticité de ses conséquences comme définie ci-après :
·
Ecart sera dit CRITIQUE si le processus ou l'activité concerné ne peut se dérouler, ou si
le produit ne peut servir à l'usage prévu.
·
Ecart sera dit MAJEUR si le processus ou l'activité concerné ne peut se dérouler autrement
que moyennant des ressources supplémentaires, ou si le produit ne peut servir
qu'avec l'apport de moyens supplémentaires.
·
Ecart sera dit MINEUR si le processus ou l'activité ou le produit est effectif mais
occasionne une gêne qui peut devenir sensible en cas de répétition ou qui nuit
à l'organisation ou l'image de marque.
Règles de décisions :
TOUT écart CRITIQUE est classé NON CONFORMITE et donne lieu
à l'ouverture d'une action corrective par le Responsable Qualité de l'entité,
ouverture approuvée par le Directeur.
Les écarts MAJEURS ou MINEURS sont soumis à l'appréciation
du pilote du processus concerné qui les classe (ou non) en NON CONFORMITE.
Toute non-conformité donne lieu à l'ouverture d'une action corrective approuvée
par le Directeur.
Notes : un écart critique non classé en non-conformité est une dérogation.
Une non-conformité ne débouchant pas sur une action corrective est une dérogation.
Les dérogations doivent être argumentées par l'autorité du processus concerné et
validées par le Responsable Qualité.
Le processus décisionnel est enregistré sur une fiche spécifique, la fiche « Ecart ». C'est un
enregistrement qualité.
6.6.
Améliorations
Le Centre de Ressources Biologiques de Lille fonde sa politique qualité sur l'amélioration
continue proactive, c'est-à-dire que les actions d'amélioration ne sont
déclenchées en réaction à un évènement. Les réunions mensuelles sont l'occasion
d'exprimer des idées d'amélioration dans tous les domaines. Une idée retenue
fera l'objet d'une action gérée validée par le Responsable Qualité et la Direction
du CRB, ceci afin d'éviter le déclenchement d'actions pouvant avoir un impact
négatifs sur des processus adjacents.
6.7.
Actions correctives et préventives
6.7.1.
Actions correctives
Les actions correctives sont déclenchées obligatoirement pour éviter la répétition d'une situation non
conforme.
Elles peuvent être déclenchées comme suite à la détection d'un écart majeur ou mineur, à l'initiative du pilote
de processus considéré, après accord du Responsable Qualité.
Les actions correctives sont gérées selon le processus suivant :
− Déclenchement, origine du déclenchement, n° de fiche écart concernée.
− Désignation d'un pilote et d'une autorité.
− Définition des objectifs à atteindre et du délai pour l'atteindre.
− Définition des limites de l'action (champ, périmètre) et analyse d'impact sur les
processus et activité adjacentes.
− Déploiement d'une méthode pour l'analyse et pour le traitement du problème posé.
− Vérification du bien fondé des solutions apportées.
− Chacune de ces étapes est tracée au moyen d'un tableur informatique.
Note : Une remise en ordre immédiate dans une situation anormale (remplacement ou réparation immédiat d'un
matériel, ajout de ressources supplémentaires)ne dispense pas de l'enregistrement sur la fiche
écart.
6.7.2.
Actions préventives
Les actions préventives sont
déclenchées, lors des revues de Direction. Elles trouvent leur justification
dans l'observation de tendances défavorables, de résultats d'analyses de données
ou dans la prise en compte d'informations évoquant un risque.
En dehors des revues de
Direction, elles peuvent être déclenchées par un responsable de secteur, après
accord du Responsable Qualité.
Les actions préventives sont
gérées selon le même processus que celui décrit pour les actions correctives.
De la même façon, les différentes étapes sont tracées.